
Elaboración de Preparaciones Cromosomicas
Introducción
La citogenética es el estudio de los cromosomas tanto en número como en estructura, los primeros pasos en la citogenética humana se dieron a finales del siglo XIX con la publicación de Flemming en 1882 de las primeras ilustraciones del cromosoma humano a partir de observaciones al microscopio, y concluyó con Tjio y Levan en 1953 cuando se determina el número real de cromosomas humanos por célula diploide (46 cromosomas). La citogenética convencional es una herramienta de gran importancia que permite realizar el diagnóstico cromosómico de pacientes con indicación clínica de cromosomopatía, lo cual les va a permitir asesorar a las familias respecto de dicha enfermedad, su pronóstico y riesgo de recurrencia (Tamar, 2008).
Así pues, los cromosomas son estructuras complejas ubicadas en el núcleo de las células, compuestos por DNA, histonas y otras proteínas no histonas, RNA y polisacáridos. Son básicamente los "paquetes" que contienen el DNA. Normalmente los cromosomas no se pueden ver con un microscopio óptico, pero durante la división celular se condensan lo suficiente como para poderse analizar fácilmente a 1.000 aumentos (Puerto, 2001).
Por lo tanto, los cromosomas se analizan a través de células que se obtiene a partir de tejidos y su cultivo en condiciones adecuadas, para conseguir células en una etapa de la división celular que permita visualizar los cromosomas. Estos se ordenan por tamaño, por posición en el centrómero o por las bandas características que presentan al someterse a tinciones, obteniéndose así el cariotipo. El cariotipo humano consta de 22 pares de cromosomas autosómicos y 1 par sexual. Un cariograma es la representación gráfica del cariotipo (Puerto, 2001).
Ahora bien, el cultivo de linfocitos y la observación de los cromosomas, se basa en la capacidad que tienen estas células para proliferar en presencia de un inductor de la división celular o mitógeno y la utilización de un agente mitostático que permite detener la división celular en la metafase (Galan, 2002). Cabe señalar, que se pueden usar distintos tejidos para obtener preparaciones de cromosomas; por ejemplo, sangre periférica, medula ósea, fluido amniótico y productos de la concepción. Aunque las técnicas específicas difieren según cuál sea el tejido, el método básico para obtener preparaciones de cromosomas es el siguiente:
-
Recolección de la muestra y preparación inicial.
-
Cultivo celular.
-
Adición de un inhibidor de la mitosis para detener las células en la metafase.
-
Recogida o cosecha de las células.
-
Tinción de las preparaciones cromosómicas para detectar los posibles cambios numéricos y estructurales (Galan, 2002).
Figura 1. Procedimiento general de obtención de cromosomas a partir de linfocitos.
Es importante destacar pues, que todas las técnicas implicadas en el estudio de la citogenética han estado en constante cambio; desde el mejoramiento del microscopio óptico, hasta la aparición de las técnicas de tinción diferencial, las cuales hicieron posible la caracterización de cada par cromosómico con mayor precisión, permitiendo la evaluación de la integridad microscópica de cada estructura. Aunque se trata de una ciencia relativamente joven la citogenética ha atravesado por una gran cantidad de avances y aportaciones tan importantes que han permitido el desarrollo de la citogenética humana, lo cual ha derivado en la detección de alteraciones numéricas y estructurales de los cromosomas, lo que ha permitido el mejoramiento de la calidad de vida humana (Swansbury, 2003).
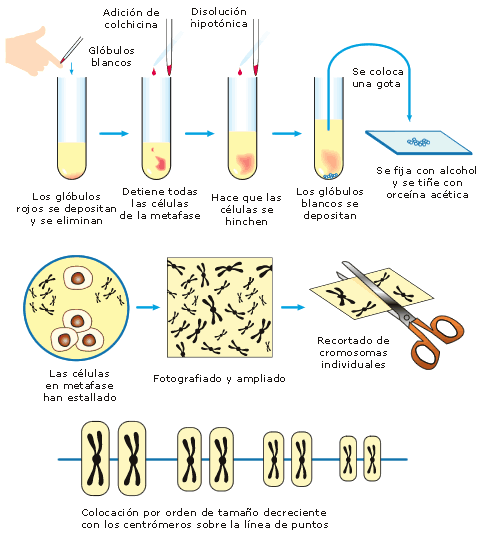
Para la obtención de cromosomas de linfocitos T (CD4), se utiliza sangre periférica, ya que es el más fácil de obtener, además de ser un método rápido, económico y no requiere de técnicas invasivas para obtener la muestra; y además proporciona una gran cantidad de células (linfocitos) en una sola toma. Para dicha obtención se utiliza heparina como anticoagulante, ya que este consigue la coagulación principalmente mediante proteoglicanos de sulfatos de heparina derivados de las células endoteliales, y no ejerce su función mediante la quelación del Ca2+ que es indispensable para la proliferación, crecimiento, y buen funcionamiento de las células (linfocitos) (Solari, 2004).
El cultivo utilizados es el RPMI 1640, que contiene nutrientes como vitaminas, aminoacidos que son esenciales para el crecimiento de las células, este también tiene una mezcla de antibióticos, Penicilina-Estreptomicina, esto para evitar que el cultivo se contaminara con bacterias que pudieran privar a las células de los nutrientes (Ascarrunz, 2005).
A dicho culivo se le agrega fitohemaglutinina (PHA), el cual es un agente mitogénico derivado de extractos de las semillas de Phaseolus vulgaris, este causa la aglutinación de los eritrocitos y estimula la mitosis progresiva de los linfocitos T (CD34) en cultivos celulares (Remel Europe, 2013) mediante el reingreso de las células en el ciclo celular debido a la inducción de los genes Hox, desde hoxb1 hasta Hoxb9, los cuales codifican para proteínas que usualmente funcionan como factores de transcripción que controlan procesos de diferenciación y desarrollo (Rodríguez, 2005).
El cultivo se debe mantener en incubación durante 71 h a 37 ºC, para obtener la mayor cantidad de células en división. No se deja por mayor tiempo debido a que los nutrientes del cultivo se terminan agotando, dejando de ser funcional para la experimentación, además de que pasado cierto tiempo, las células alcanzan un estado de confluencia, donde establecen contacto entre ellas e inhiben su proliferación. Asimismo, se incuban a 37 ºC ya que es la temperatura óptima a la cual se mantienen los linfocitos en el cuerpo humano (Pack, 2002 ).
Una vez transcurrido el tiempo de incubación, se agrega colchicina al 0.04 %, esto con la finalidad de detener al mayor número de células (linfocitos) en metafase, puesto que es un fármaco antimitótico, que tiene acción sobre las proteínas citoesqueléticas del huso mitótico denominadas tubulinas, lo cual ocasiona que los cromosomas no puedan migrar, deteniéndose por completo el proceso de división celular en metafase (Galan, 2002).
Para la cosecha de los linfocitos, se agrega en primera instancia solución hipotónica (KCL-0.075M) con EDTA, para hinchar los núcleos y permitir la lisis de los eritrocitos, así como permitir posteriormente la buena dispersión y separación de los cromosomas, el EDTA, permite romper las membranas celulares, tras ello, se agrega solución fijadora de metanol/ácido acético (3:1) para la lisis celular y preservación integral de la estructura de los cromosomas (Tompson, 2008), realizándose varios lavados para eliminar todos los residuos del medio de cultivo utilizado así como los compuestos que se adicionaron.
Una vez terminada la cosecha, se gotean de 3-4 gotas de la suspensión en un portaobjetos, desde una altura de metro y medio para poder hacer explotar a las células y se esparzan correctamente los cromosomas en el portaobjetos. Paso siguiente a esto se dejan madurar las laminillas, para después teñirlas con la tinción de Giemsa y al final poder observarlas, esta tinción mencionada es de tipo Romanowsky, es decir, que utiliza azul de metileno y sus productos de oxidación (azur A, B y C) como colorante básico, y al tener un pH básico se unirá a estructuras y moléculas ácidas, como el DNA, por lo que teñirá de azul o púrpura los núcleos, así también, se emplea eosina como colorante ácido, por lo que se une a estructuras básicas como el citoplasma, tiñendo de color rosado. Cabe mencionar también, que el azul de metileno se une fuertemente a las regiones ricas en adeninas y timinas del DNA (Madrigal, 2002).
Fundamentos










Materiales










Metodología



Resultados

Metafase obtenida a partir de linfocitos T, con tinción de Giemsa, observada a 100X.

Metafase obtenida a partir de linfocitos T, con tinción de Giemsa, observada a 100X. .

Metafase obtenida a partir de linfocitos T, con tinción de Giemsa, observada a 100X.

Metafase obtenida a partir de linfocitos T, con tinción de Giemsa, observada a 100X.

Metafase obtenida a partir de linfocitos T, con tinción de Giemsa, observada a 100X. Hay ausencia de un cromosoma 16.

Metafase obtenida a partir de linfocitos T, tenida con Giemsa, observada a 100X.

Hecho a partir de Metafase 3. Cariotipo: 46 XX
Utilidad
La obtención de cromosomas a partir de linfocitos, permiten realizar y analizar cariotipos de cualquier organismo vivo, es fundamental como parte de su caracterización biológica, ya que nos permite conocer el número y el tipo de cromosomas que posee; en estudios de evolución, nos ayudan a entender la historia evolutiva –a nivel molecular– del organismo. En el caso del hombre, los cariotipos tienen una importancia médica ya que permiten hacer un diagnóstico referente a anomalías numéricas y estructurales, sobre todo en estados prenatales, permitiendo establecer posibles tratamientos, etc., para disminuir la incidencia de dichas anomalías.
Sin embargo, en la actualidad este tipo de estudios son demasiados costosos por lo que la observación de cromosomas se reduce a algunas pocas personas. Por lo que se espera que el futuro todas las personas tengan acceso a dichas técnicas.

Actividad Complementaria
A continuación resuleve lo que se te indica en cada imagen


¿Cuántos cromosomas se observan en la imagen?
Identifica a los cromosomas del grupo A (1, 2 y 3).
En qué fase se encuentra la célula. Explica qué pudo ocurrir.

Referencias
-
Ascarrunz, E., et. al. (2005). “Evaluación de riesgo genotóxico: biomonitorización de trabajadores agrícolas de Caranavi, Guanay, Palca y Mecapaca, expuestos a plaguicidas”. Cuad. Hosp. Clín., 50(2):27-37.
-
Galan GE. (2002) “Aplicaciones de laboratorio de citogenética a la clinica.” Pediatrica Integral; 6(9): 820-830
-
Madrigal, E. (2002). “Efecto genotóxico de la crocidolita en cultivo de linfocitos humanos”. Bioquimia, 27(1):8-12.
-
Pack SD. Stratakis CA (2002) “Chromosomes: Methods for preparation”. Encyclopedia of life science. John Wiley & Sons.
-
Puerto NS. (2001). Relación entre heterogeneidad intragenómica y formación de aberraciones cromosómicas. Tesis Doctoral. Universidad Autónoma de Barcelona, España.
-
Rodríguez AR. (2005). “Manual de prácticas de genética y cuaderno de trabajo”. (1a Ed). México: UNAM. pp. 80-155.
-
Silva, Claudia; Contreras, Nora; Fonseca J, Dora. (2008). Utilidad de la citogenética en la medicina actual. Acta Med Colomb, 33(4): 56-67.
-
Solari AJ (2004). “Genética humana: Fundamentos y Aplicaciones en Medicina”. (3ª Ed). Argentina: Médica Panamericana.
-
Thompson y Thompson (2008). Genética en medicina. México: Sauders. pp. 584.
-
Swansbury J. (2003). Cáncer Cytogenetics Methods and protocols. Volumen 220. Editorial Human Press. USA. pp. 152-154,260

